- 發(fā)布時間2024-03-15 11:07
- 發(fā)布人金彩集團
- 瀏覽次數(shù)428
2023年度“中國科學十大進展”分別為:
人工智能大模型為精準天氣預報帶來新突破
揭示人類基因組暗物質驅動衰老的機制
發(fā)現(xiàn)大腦“有形”生物鐘的存在及其節(jié)律調控機制
農作物耐鹽堿機制解析及應用
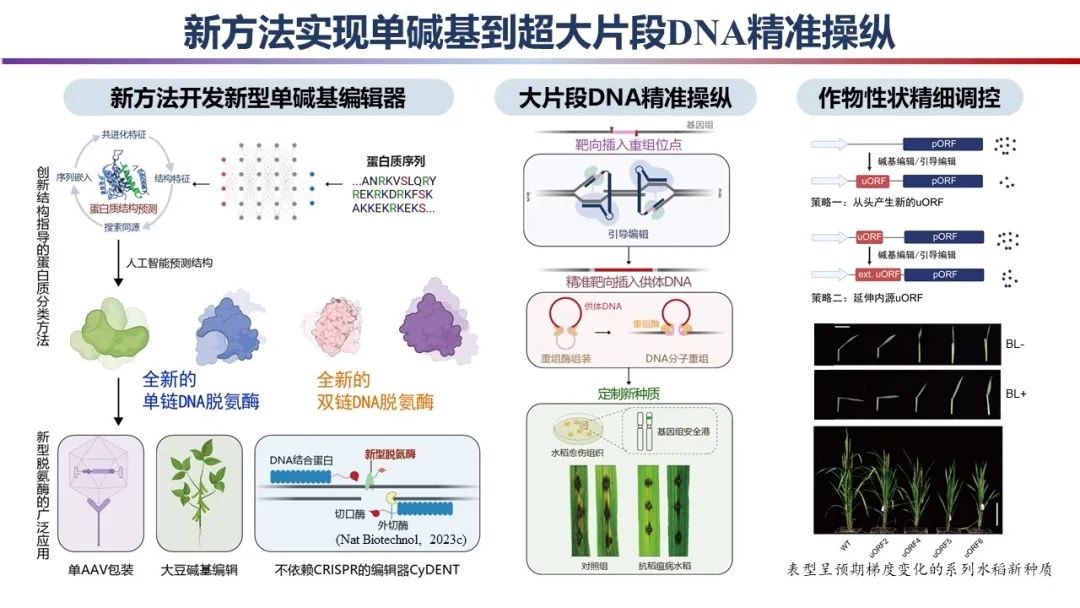
新方法實現(xiàn)單堿基到超大片段DNA精準操縱
揭示人類細胞DNA復制起始新機制
“拉索”發(fā)現(xiàn)史上最亮伽馬暴的極窄噴流和十萬億電子伏特光子
玻色編碼糾錯延長量子比特壽命
揭示光感受調節(jié)血糖代謝機制
發(fā)現(xiàn)鋰硫電池界面電荷存儲聚集反應新機制
其主要技術貢獻有三點。一是采用了三維神經網(wǎng)絡結構,更好地建模復雜的氣象過程。二是采用地球位置編碼技術,提升訓練過程的精度和效率。三是訓練具有不同預測時效的多個模型,減少迭代誤差、節(jié)約推理時間。
盤古氣象大模型在某些氣象要素的預報精度上超越了傳統(tǒng)數(shù)值方法,且推理效率提高了上萬倍。在全球高分辨率再分析數(shù)據(jù)上,盤古氣象大模型在溫度、氣壓、濕度、風速等重要天氣要素上,都取得了更準確的預測結果,將全球最先進的歐洲氣象中心集成預報系統(tǒng)的預報時效提高了0.6天左右。
盤古氣象大模型也可用于極端天氣預報。在2023年汛期,盤古氣象大模型成功預測了瑪娃、泰利、杜蘇芮、蘇拉等影響我國的強臺風路徑。
在人類基因組中,“暗物質”——非編碼序列占據(jù)了98%,其中有約8%是內源性逆轉錄病毒元件,它是數(shù)百萬年前古病毒入侵并整合到人類基因組中的殘留物,通常情況下處于沉默狀態(tài)。然而,隨著年齡的增長,這些沉睡的古病毒“化石”的封印是否會被揭開,進而加速我們身體的衰老進程尚不得而知。
中國科學院動物研究所劉光慧研究員帶領研究團隊,通過搭建生理性和病理性衰老研究體系,結合高通量、高靈敏性和多維度的多學科交叉技術,揭示在衰老過程中,表觀遺傳“封印”的松動將導致原本沉寂的古病毒元件被重新激活,并進一步驅動衰老的“程序化”和“傳染性”。
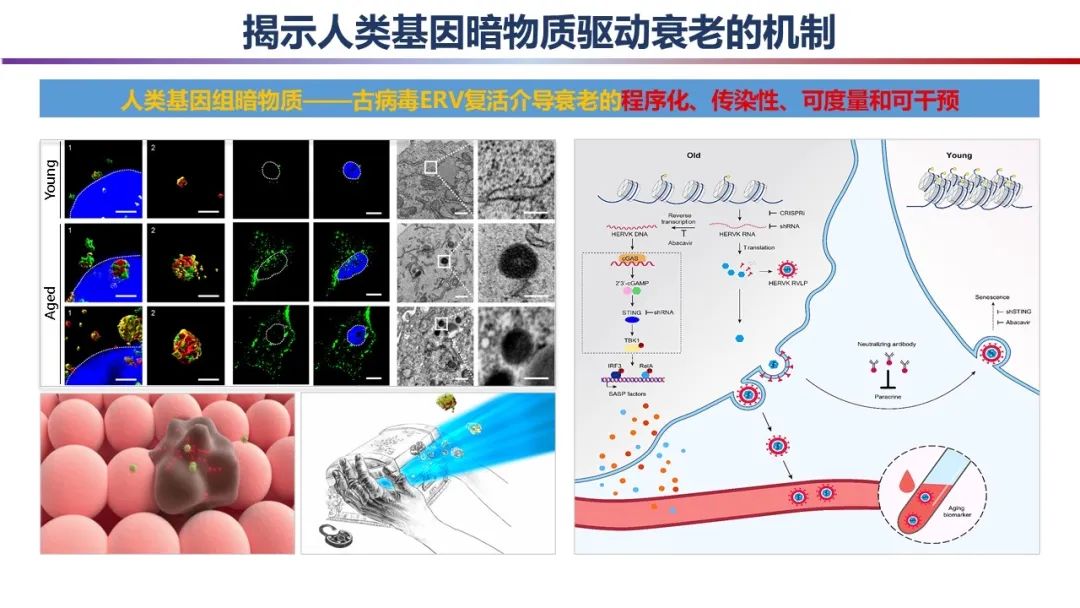 這項工作提出了古病毒的“復活”驅動衰老及相關疾病的新理論,為理解衰老的內在機制和發(fā)展衰老干預策略提供了新依據(jù),為科學評估和預警衰老、防治衰老相關疾病以及積極應對人口老齡化提供新思路。
這項工作提出了古病毒的“復活”驅動衰老及相關疾病的新理論,為理解衰老的內在機制和發(fā)展衰老干預策略提供了新依據(jù),為科學評估和預警衰老、防治衰老相關疾病以及積極應對人口老齡化提供新思路。軍事醫(yī)學研究院李慧艷研究員和張學敏研究員通過合作研究發(fā)現(xiàn)了大腦“有形”生物鐘的存在。他們發(fā)現(xiàn)大腦生物鐘中樞SCN神經元長有“天線”樣的初級纖毛,每24小時伸縮一次,如同生物鐘的指針,通過它可實現(xiàn)對機體生物鐘的調控。
大腦SCN區(qū)域具有大約2萬個神經元。神奇的是,這2萬個神經元始終保持著“同頻共振”,維系著生物鐘的穩(wěn)定性,但機理始終是個謎團。他們發(fā)現(xiàn)初級纖毛可能通過調控SCN區(qū)神經元的“同頻共振”調節(jié)節(jié)律,其機制與Shh信號通路密切相關。該“有形”生物鐘的發(fā)現(xiàn),對于理解生物鐘的構造以及分子層面與細胞層面生物鐘的聯(lián)系具有重要意義,為節(jié)律調控新藥研發(fā)開辟了新的路徑。
我國有15億畝鹽堿地未被有效利用,通過培育耐鹽堿農作物,可提高鹽漬化土地產能,將為我國糧食安全提供有效保障。盡管學術界對于植物耐鹽性有較深入認知,但對植物耐堿脅迫的認識嚴重不足,這阻礙了耐鹽堿作物的培育。

中國科學院遺傳與發(fā)育生物學研究所謝旗領銜的8家單位科研團隊聯(lián)合攻關,在糧食作物耐鹽堿領域取得重要突破。
通過對耐鹽堿差異大的高粱資源全基因組大數(shù)據(jù)進行關聯(lián)分析,研究團隊發(fā)現(xiàn)一個主效耐堿相關基因AT1,編碼G蛋白亞基。不同的AT1基因突變型在調控這一過程中發(fā)揮決定作用,為作物耐堿理論研究提供了新視角。研究還發(fā)現(xiàn)在水稻、玉米及小作物谷子等主要糧食作物中AT1調控機制也是類似的,為主要作物的耐鹽堿分子育種奠定了理論基礎。
在取得理論突破的基礎上,團隊對高粱進行耐鹽堿育種改良。在寧夏平羅鹽堿地進行的田間實驗表明,AT1基因的利用能夠使高粱籽粒產量和全株生物量增加。AT1基因還可用于改善主要禾本科作物水稻、小麥、小米和玉米等的耐鹽堿性。
中國科學院遺傳與發(fā)育生物學研究所高彩霞團隊與北京齊禾生科生物科技有限公司的趙天萌團隊合作,實現(xiàn)了基因組編輯在方法建立、技術研發(fā)和工具應用的多層次創(chuàng)新。
研究團隊首次運用人工智能輔助的結構預測建立了蛋白聚類新方法,率先將基于結構分類的理念引入工具酶挖掘領域,并基于此開發(fā)了系列具有重要應用價值的新型堿基編輯器和我國完全擁有自主產權的、首個在細胞核和細胞器中均可實現(xiàn)精準堿基編輯的新型工具CyDENT。
此外,研究團隊開發(fā)了首個植物大片段DNA精準定點插入技術,為高效作物育種和植物合成生物學奠定了技術基礎。研究團隊還利用基因組編輯實現(xiàn)了作物性狀的精準調控。該成果有望進一步拓寬基因組編輯的育種應用,助力作物種質創(chuàng)新。
為了深入了解人體細胞DNA復制是如何開始的,該項工作解析了人體內的MCM雙六聚體復合物的冷凍電鏡結構。
在這個結構中,復制起點DNA,被固定在MCM的中央通道里,形成一個初始開口結構。形成該結構,DNA雙鏈需要被拉伸和解開。
該研究還發(fā)現(xiàn),如果初始的開口結構被破壞,那么所有的MCM-DH就無法穩(wěn)定地結合在DNA上,導致DNA復制完全被抑制,就像是復印機壞了,無法開始復印文件一樣。
這一發(fā)現(xiàn)對癌癥治療有重要的應用價值。因為癌癥細胞在生長過程中必須進行DNA復制。在不影響正常細胞運作的情況下,通過阻止癌細胞在DNA上組裝MCM雙六聚體,將會是一種全新的、有效的、而且非常精準的抗癌療法,為抗癌藥物的研發(fā)開辟了新的道路。
我國高海拔宇宙線觀測站“拉索”(LHAASO)首次記錄了伽馬暴萬億電子伏特光子爆發(fā)的全過程,探測到早期的上升階段,由此推斷噴流具有極高的相對論洛倫茲因子。“拉索”還看到了GRB 221009A(史上最亮伽馬暴,起源于24億光年外的大質量恒星死亡瞬間)的余輝在700秒左右出現(xiàn)了快速下降,這一光變拐折現(xiàn)象被認為是觀測者看到了噴流的邊緣所致。從光變拐折的時間得到噴流的半張角僅有0.8度。這是迄今發(fā)現(xiàn)最窄的伽馬暴噴流,意味著它實際上是一個典型結構化噴流的核心。

“拉索”還精確測量了高能伽馬射線的能譜,呈現(xiàn)單一的冪律,延伸至十萬億電子伏特以上。這是伽馬暴觀測到的迄今最高能量的光子。在余輝標準模型下,高能余輝輻射起源于相對論電子的逆康普頓散射,理論預期這樣的能譜在高能段會逐漸變軟。但“拉索”的觀測沒有發(fā)現(xiàn)能譜變軟現(xiàn)象,這對伽馬暴余輝標準模型提出了挑戰(zhàn),意味著十萬億電子伏特光子可能產生于更復雜的粒子加速過程或者存在新的輻射機制。
量子糾錯是解決該問題的重要途徑,通過量子編碼使得一個被保護的邏輯量子比特的相干壽命,超過量子電路中最好的物理比特的相干壽命。此時,意味著糾錯過程超越了量子糾纏的盈虧平衡點,這是構建邏輯量子比特的必要條件。
但量子態(tài)具有不可克隆性,量子計算機無法通過備份來糾正錯誤,量子糾錯過程會引入新的錯誤,造成誤差累積,甚至出現(xiàn)越糾越錯的局面。
南方科技大學和深圳國際量子研究院的俞大鵬院士與徐源研究團隊,聯(lián)合福州大學鄭仕標、清華大學孫麓巖等團隊依據(jù)玻色編碼量子糾錯方案,開發(fā)了基于頻率梳控制的低錯誤率宇稱探測技術,大幅延長邏輯量子比特的相干壽命,超盈虧平衡點達16%,實現(xiàn)了量子糾錯增益。該成果是通往容錯量子計算道路上的一項重要成果。
中國科學技術大學薛天研究團隊發(fā)現(xiàn)光暴露顯著降低小鼠的血糖代謝能力。哺乳動物感光主要依賴視網(wǎng)膜上的視錐、視桿細胞和對藍光敏感的自感光神經節(jié)細胞(簡稱ipRGC)。利用基因工程手段,研究團隊發(fā)現(xiàn)光降低血糖代謝由ipRGC感光獨立介導。進一步研究發(fā)現(xiàn)光信號經由視網(wǎng)膜ipRGC,至下丘腦視上核、室旁核,進而到達腦干孤束核和中縫蒼白核,最后通過交感神經連接到外周棕色脂肪組織,并最終確定了光降低血糖代謝的原因,是光經由這條通路抑制棕色脂肪組織消耗血糖的產熱。進一步研究表明,光同樣可利用該機制降低人體的血糖代謝能力。
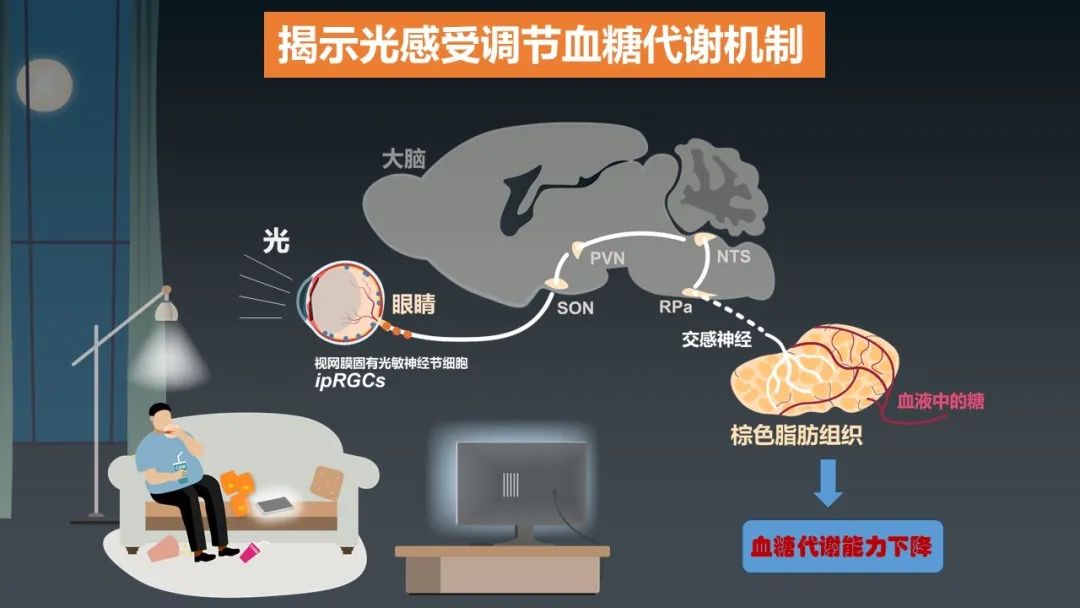 這項研究發(fā)現(xiàn)了全新的“眼-腦-外周棕色脂肪”通路,回答了長久以來未知的光調節(jié)血糖代謝的生物學機理,拓展了光感受調控生命過程的新功能。這項工作發(fā)現(xiàn)的感光細胞、神經環(huán)路和外周靶器官,為防治光污染導致的糖代謝紊亂提供了理論依據(jù)與潛在的干預策略。
這項研究發(fā)現(xiàn)了全新的“眼-腦-外周棕色脂肪”通路,回答了長久以來未知的光調節(jié)血糖代謝的生物學機理,拓展了光感受調控生命過程的新功能。這項工作發(fā)現(xiàn)的感光細胞、神經環(huán)路和外周靶器官,為防治光污染導致的糖代謝紊亂提供了理論依據(jù)與潛在的干預策略。
近百年來,電化學界面反應通常被認為僅存在“內球反應”和“外球反應”單分子途徑。該研究揭示出電化學界面反應存在第三種“電荷存儲聚集反應”機制,加深了對多硫化物演變及其對電池表界面反應動力學影響的認識,為下一代鋰硫電池設計提供指導。
信息來源:科技日報










 ,同時按鍵盤或小鍵盤上的
,同時按鍵盤或小鍵盤上的  ,放大視圖顯示。
,放大視圖顯示。
 ,縮小視圖顯示。
,縮小視圖顯示。




 蘇公網(wǎng)安備 32098102321209號
蘇公網(wǎng)安備 32098102321209號
